NAD+ IV 使人类血浆中的 NAD+ 水平提高 400%
这项刚刚发表的研究记录了在静脉内 (IV) 输注 750 毫克 NAD+ 期间和之后血浆和尿液中 NAD+ 及其代谢物水平的变化。
一项调查 6 小时静脉输注 NAD+ 期间人体血浆和尿液 NAD+ 代谢组变化的初步研究
令人惊讶的是,直到 2 小时后才观察到血浆 (NAD+) 或代谢物烟酰胺 (NAM)、甲基烟酰胺 MeNAM)、腺苷磷酸核糖核糖 (ADPR) 和烟酰胺单核苷酸 (NMN)] 的变化。
在 6 小时时检测到尿液中 MeNam 和 NAD+ 的排泄增加,但未观察到尿液 NAM 的显着增加。
该研究首次揭示:(i) 以 3 μmol/min 的输注速率
- 至少在最初的 2 小时内,NAD+ 会从血浆中快速完全去除;
- 代谢物的特征与 NAD+ 糖水解酶和 NAD+ 焦磷酸酶活性一致
- 尿液排泄产物包括 NAD+ 本身和 meNAM 但不包括 NAM
增加 NAD+ 水平的最直接方法是通过静脉内 (IV) 给药。
令人惊讶的是,虽然正在积极研究口服 NAD+ 前体,如烟酰胺核糖苷 (NR) 或烟酰胺单核苷酸 (NMN) 对 NAD+ 水平的影响,但这项研究首次展示了 NAD+ 及其代谢物浓度的变化在一组健康男性参与者中静脉输注 NAD+。
11 名年龄在 30-55 岁之间的男性参与者被随机分配到测试组 (n = 8) 或对照组 (n = 3)。测试组的参与者在 6 小时内静脉注射 750 mg NAD+ 生理盐水。
安全性
在 6 小时输注安慰剂(盐水)或测试(NAD+)队列期间,未观察到不良事件。
结果
在 NAD+ 输注开始后 8 小时观察到肝功能酶 GGT、LD 和 AST 的活性显着降低(1.3、57、3.6 单位/L)(表 1)。在安慰剂(生理盐水)处理的样品中,8 小时时任何肝功能标志物的活性都没有明显变化,但是样品数量少可能会降低辨别灵敏度。还观察到血浆胆红素显着增加 2.75 μmoles/L。然而,这些变化都没有被认为具有临床意义。
表 1 – 肝脏
等离子体
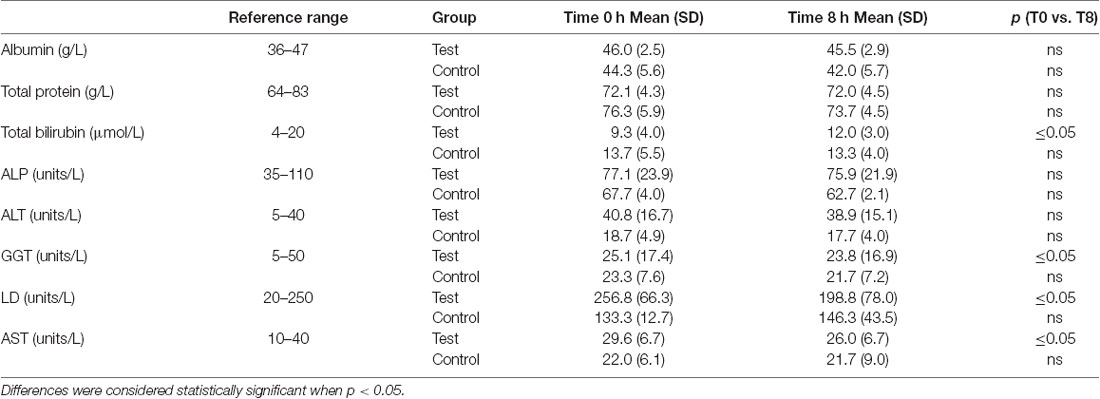
- NAD+ 水平在 6 小时时间点增加了 398%
- 相对于基线和盐水处理的对照样品,NAD+ 水平在 8 小时(即输注后 2 小时)时保持升高。
- NAM 在 6 小时时显着增加了 409%
- NAM 水平在 8 小时时恢复到基线
- NAD+ 代谢物 ADPR 在 6 小时时显着增加 393%
- MeNam 在 6 小时时增加到 350%
- NMN 仅在 8 小时时间点升高了 472%
图 1 – 血浆代谢物
尿
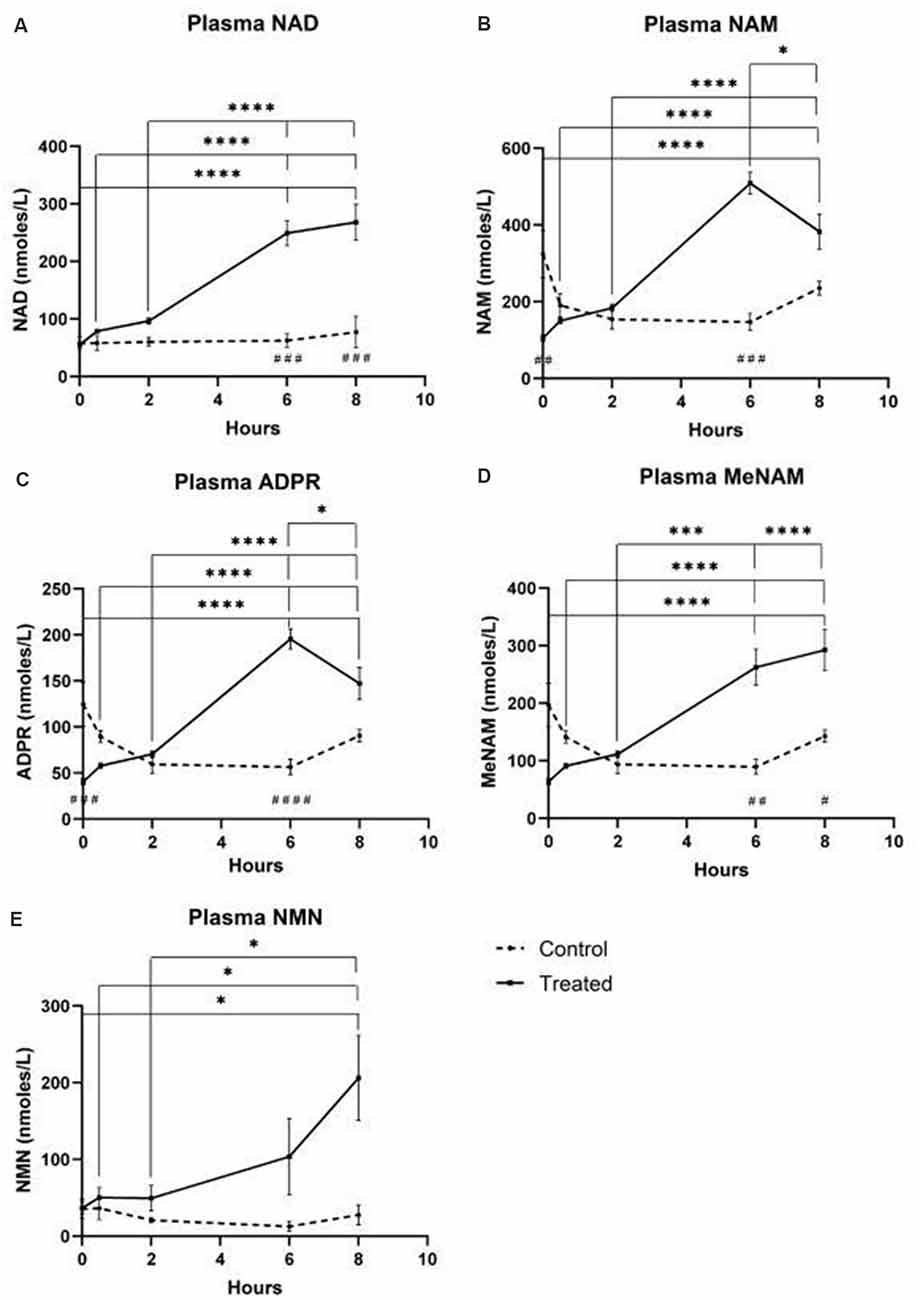
- NAD+ 在 6 小时时间点增加了 538%
- 在 8 小时的测试期间,NAM 没有显着变化
- MeNAM 在 6 小时时间点增加 (403%)
图 2 – 尿液代谢物
讨论
重要的是,NAD+ 的输注在测试队列中没有产生任何可观察到的不良事件,而是降低了指示肝应激的酶的血浆活性,例如肝内 LD 和 AST 以及肝后(胆管)酶 GGT,这表明两者的完整性即使在相对较短的 8 小时时间内,肝内和肝后组织也得到增强。
然而出乎意料的是,在 NAD+ 输注参与者中,血浆 NAD+ 水平直到 2 小时时间点后才上升,NAD+ 和代谢物 NAM、meNAM 和 ADPR(分别为 398%、409%、393%)达到基线以上约 400% 的最大值仅在 6 小时时间点(图 1A–E)。这与 NAD+ 和 meNAM 的尿液排泄峰值也发生在 6 小时,然后在输注结束后迅速下降。
血浆 NAM 和 ADPR 的平行上升(相关系数为 1.000,p < 0.001,数据未显示)强烈表明,至少到 6 公顷,NAD+ 的主要命运是通过糖苷 ADPribose-烟酰胺与 NAM 和 ADPR 的裂解进行代谢, NAD 糖水解酶(如 CD38)活性的副产物。这与其他人的证据一致,特别是 CD38 已被证明在控制细胞外 NAD+ 水平方面具有主要作用(Wei 等人,2014 年)。
直到输注前 2 小时后,血浆或尿液中 NAD+ 或代谢物没有任何升高表明 NAD+ 和/或其代谢物被运出细胞外血管空间,并有效地隔离到组织或血管外隔室中,如在此期间的 NAD+ 和/或其代谢物。
虽然存在将外源性静脉注射 NAD+ 快速降解为组成代谢物的显着能力,但还值得注意的是,细胞外 NAD+ 的摄取也可能发生。
由于 NAD+ 具有整体负电荷,因此它无法被动地穿过细胞膜,因此必须主动运输穿过细胞膜。许多研究人员已经证明了这种情况的发生,他们报告说,应用于多种人类细胞类型的外源性 NAD+ 确实会导致细胞内 NAD+ 显着升高
虽然所涉及的机制尚未完全表征,但 Alano 等人。(2010) 报道外源性 NAD+ 可以通过 P2X7 门控通道进入神经元,其他人一直观察到 NAD+ 通过连接蛋白 43 (CX43) 半通道跨膜转运,即使浓度低至 250 pM(Billington 等人,2008)。由于连接蛋白在人体组织中分布广泛,而 CX43 似乎是许多细胞类型中最普遍存在的连接蛋白,因此不能低估快速摄取 NAD+ 的潜力。
因此,至少在前 2 小时,NAD+ 和代谢物 NAM 和 ADPR 以及次级代谢物 meNAM 和 NMN 的细胞摄取和/或代谢似乎与 3 μmoles/min NAD+ 输注同步进行。
NAD+ 和/或测试的主要代谢物在前 2 小时期间被有效隔离,或者次级代谢物也正在形成。
为支持这一假设,其他人已将血液腺苷水平升高视为细胞外 NAD+ 输注的结果。
然而,2 小时后血浆 NMN 的升高也表明外源性 NAD+ 可能受到细胞外 NAD+ 焦磷酸酶的作用,升高血浆 NMN 并释放 AMP 作为额外的代谢物。
总之,这项研究首次揭示:(a) 在 3 μmole/min 的流速下,所有外源性注入的 NAD+ 至少在前 2 小时内从血浆中快速且完全去除;(b) 分析的代谢副产物的增加与 NAD+ 糖水解酶和 NAD+ 焦磷酸酶活性一致;(c) 输注 NAD+ 产生的尿液排泄产物包括天然 NAD+ 和 meNAM,但不包括 NAM。

