
外源性烟酰胺腺嘌呤二核苷酸通过下丘脑连接蛋白 43 调节能量代谢。
这项研究有一些非常重要的发现:
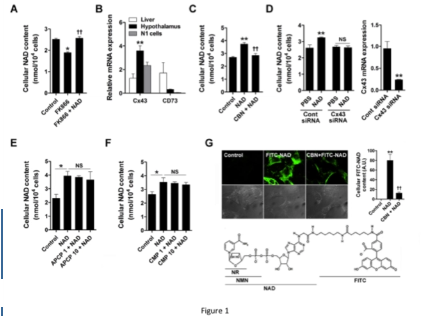
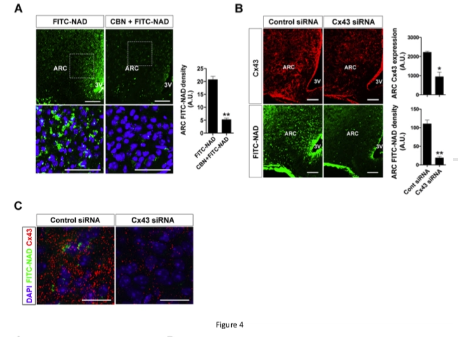
- 外源性 NAD+ 肯定会通过连接蛋白 43 缝隙连接穿过血脑屏障
- 外源性NAD+容易进入下丘脑显着增加NAD+水平
- 下丘脑中 NAD+ 的增加对新陈代谢、增加能量消耗和减少饥饿感有很强的影响
- NMN 和 NR 无法穿过血脑屏障并影响下丘脑中的 NAD+ 水平
- 进一步证实细胞外 NAD+ 在全身水平上起作用以增加下丘脑中的 Sirt1 活性,从而增加新陈代谢
这项研究表明,给予 1 mg/kg 的 LABELED NAD+ 会穿过血脑屏障完整地进入下丘脑,增加 NAD+ 水平,减少饥饿感和体重增加,并增加小鼠的能量消耗和脂肪燃烧。
这项研究表明,血液中增加的 NAD+ 水平对体内的代谢活动有积极影响。
他们还表明 NR 和 NMN 不能利用 cd43 间隙穿过血脑屏障。
这或许可以解释为什么 NAD+ 诊所在治疗成瘾和其他大脑失衡方面取得了成功,但 NR 和 NMN 却没有以类似的方式使用。
补充 NAD+ 对新陈代谢的积极影响也不同于补充 NR 和 NMN。
系统性影响
提高下丘脑的 NAD+ 水平对整个身体都有很大的影响,因为它可以调节饥饿感和能量消耗。
更诱人的是衰老本身可能产生的影响。下丘脑作为主衰老时钟是一个可信的衰老理论。将下丘脑中的 NAD+ 水平恢复到幼小动物的水平,很可能会对全身器官和组织产生积极影响。
NAD+ 随着年龄的增长而下降
NAD+ 下降已被认为是与年龄相关的体重增加和昼夜节律功能下降的核心机制 [ 15、17 ]。除了衰老,慢性高脂肪、高蔗糖食物摄入也会降低小鼠下丘脑 SIRT1 蛋白水平和 NAD 含量,导致下丘脑神经元 SIRT1 活性降低 [17 ]。
减少 NAD+ 影响 Sirt1 作用
由于 NAD 依赖性 SIRT1 活性在正常代谢功能中的重要性 [18],已经提出了激活细胞 NAD-SIRT1 轴的治疗策略。几项研究报告了 SIRT1 激活化合物的代谢益处,包括多酚,如白藜芦醇和合成小分子 SIRT1 激活剂 [ 19 ]。
在之前的研究中,NAD+ 前体已被用于增加 NAD+
据报道,补充 NAD 前体 NMN 和 NR 通过恢复外周代谢器官中的 NAD 水平,对肥胖或老年小鼠产生有益的代谢作用。
细胞外 NAD 可增加细胞内 NAD 水平
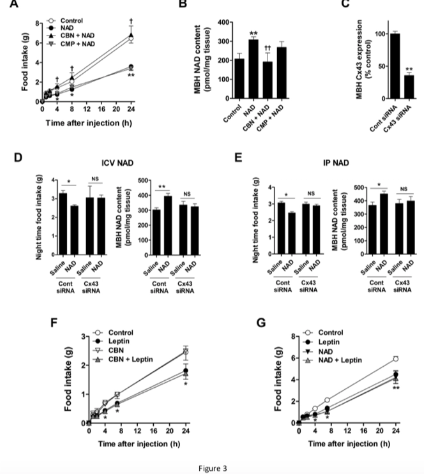
我们的研究表明,补充 NAD 有效地增加了小鼠下丘脑 NAD 的含量。
减少饥饿感
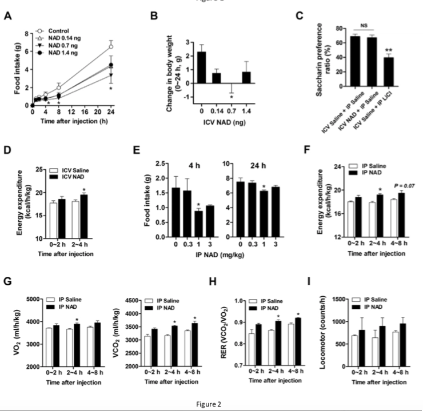
10 周大的小鼠在禁食过夜后通过静脉注射 0.14、0.7 或 1.4 毫克的 NAD。
当给小鼠提供无限量的食物时,0.7 剂量在抑制食物消耗和体重增加方面最有效。
这种食欲抑制在注射 NAD+ 后持续了 24 小时。
在不同的实验中,健康的年轻小鼠禁食过夜,然后通过 IP 注射 0.3、1 或 3 mg/kg 给予 NAD+。在 4 小时内,所有 3 组的食物摄入量都显着减少。1 mg/kg 剂量的饥饿感减少持续 24 小时。
能量增加
注射 0.7 ng NAD+ 的小鼠在注射后 24 小时内能量消耗增加(图 2D)。
在第二个实验中,通过 IP 给予 1 mg/kg NAD+ 的小鼠在 24 小时内显着增加了能量消耗。
IP NAD 给药小鼠的耗氧量 (VO2) 和二氧化碳产生量 (VCO2) 高于 IP 生理盐水给药的对照组(图 2G)。
切换到脂肪燃烧与碳水化合物
IP 注射 1 mg/kg 导致更高的 RER,这表明更倾向于燃烧脂肪而不是碳水化合物为身体提供能量。总体活动水平没有改变。(图 2H 和 I)
剂量高 100 倍时安全
以 100 mg/kg 的剂量腹腔注射两周 NAD 不会对动物行为、血细胞计数和肝肾功能产生任何不良毒性作用。
在比 NR 和 NMN 低得多的剂量下有效
值得注意的是,IP给药的 NAD 的有效剂量(1 mg/kg)比 IP NMN 的有效剂量低约 100 倍 [ 26、28 ]。
与 NR 和 NMN 相比,外源性 NAD+ 似乎更有效地提升大脑中的 NAD+
最近的一项研究报告说,口服的 NMN 和 NR 在进入全身循环之前大部分在肝脏中降解为烟酰胺,并且这些 NAD 前体在循环中的主要产物是烟酰胺。[ 39 ]
重要的是,外源性 NMN 或 NR 不会穿过血脑屏障,并且似乎通过向 NAD 补救途径提供烟酰胺来增加大脑 NAD 含量。
此外,NMN 或 NR 诱导的组织 NAD+ 水平增加在大脑中低于肝脏和肾脏。
高龄和肥胖导致下丘脑 NAD+ 水平低
饮食诱导的肥胖小鼠和遗传性肥胖 db/db 小鼠的下丘脑 NAD 含量显着降低 [ 17 ]。
Wistar 大鼠和人类的大脑 NAD 水平也会随着年龄的增长而降低 [ 38 ]。
此外,单次中枢和外周给药 NAD 可抑制禁食引起的摄食过多和体重增加而无不良影响,表明补充 NAD 对中枢神经系统能量平衡失调和/或 NAD 缺乏的动物和人类具有治疗益处。
因此,需要进一步的研究来测试长期补充 NAD 对肥胖和与衰老相关的体重增加的治疗效果。
外源性 NAD 可直接转运至下丘脑神经元。
血液中的 NAD+ 水平可能预示着大脑中的代谢反应
尽管我们的研究重点是外源性 NAD,但内源性 NAD 可以从细胞中释放出来 [40],并且存在于人类和小鼠的血液和细胞外液中 [ 41 ]。
事实上,适度运动后 [ 41 ] 和进行性多发性硬化症患者 [ 43 ] 的血液 NAD 水平会升高,这意味着调节 NAD 分泌的生理或病理生理机制。
累积的证据还表明,NAD 作为细胞外因子发挥着重要作用 [ 40 ]。
外源性 NAD 通过调节 Sirt1 影响能量稳态
在我们的工作中,先前 ICV 给予 sirtuin 抑制剂 sirtinol 和 SIRT1 抑制剂 EX527 显着抑制了外源性 NAD 对食物摄入和体重的影响,表明 NAD 的作用是通过下丘脑 sirtuins 介导的。
根据我们的发现和之前的发现,我们提出了 Cx43 在下丘脑 NAD+ 转运和外源性 NAD+ 代谢效应中的作用(图 6)。
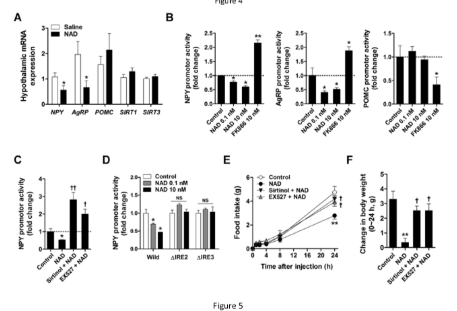
在胚胎下丘脑神经元细胞中,细胞外 NAD 通过 Cx43 半通道转运到细胞内,从而通过 SIRT1/FOXO1 抑制 NPY/AgRP 表达。
在小鼠中,外源性 NAD 可通过血脑屏障处的 Cx43 转运至下丘脑,从而增加下丘脑 NAD 含量并减少食物摄入和体重增加。
结论:
总之,我们的结果表明外源性 NAD 有效地输入到下丘脑并增加了下丘脑 NAD 含量。因此,NAD 补充剂可以构成以人类下丘脑 NAD 耗竭为特征的代谢紊乱的治疗方法。
相关的研究:
下丘脑调节能量消耗和饥饿感(Timper,2017 年)
调节食欲和能量稳态的下丘脑回路:通往肥胖的途径
尤其是下丘脑已经成为全身能量稳态的综合、高级主调节器
总之,下丘脑在调节人类和啮齿动物的食欲和食物摄入方面起着关键作用
下丘脑炎症会损害胰岛素和瘦素的作用,不仅会导致摄食过多和肥胖的发展,还会导致相关的葡萄糖稳态失调
食欲和饱腹感的大脑调节
能量稳态主要由下丘脑和脑干中的神经回路控制,
能量代谢的大脑调节 (Roh, 2016)
下丘脑是控制食物摄入和体重的大脑区域
瘦素和胰岛素向下丘脑发出身体能量储存状态的信号。
能量稳态的下丘脑调节 (Sainsbury, 2002)
这些外周激素通过激活或抑制下丘脑内的促食欲肽或厌食肽的活性来影响它们对能量稳态的影响
下丘脑作为主要衰老时钟
建立大脑控制衰老的案例
下丘脑有衰老时钟吗?
涉及 IKK-b、NF-kB 和 GnRH 的系统性衰老的下丘脑编程(Zhang,2014 年)







